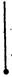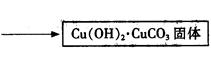题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: 步骤一
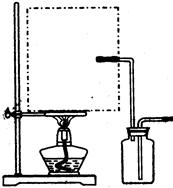
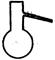
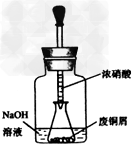
| 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: 步骤一:废铜屑制硝酸铜 如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。 步骤二:碱式碳酸铜的制备 向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。 完成下列填空: |
|
| (1)写出浓硝酸与铜反应的离子方程式。________________________ (2)上图装置中NaOH溶液的作用是__________。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。 (3)步骤二中,水浴加热所需仪器有_______、_______(加热、夹持仪器、石棉网除外);洗涤的目的是____________。 (4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。 ________________________________ (5)影响产品产量的主要因素有____________。 (6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。 |
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案

 更多“碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料…”相关的问题
更多“碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料…”相关的问题