 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在0.5mol·L-1H2SO4介质中,测定混合离子溶液中各自的浓度。测定的工作波长为440nm,测定的工作波长为550nm,当
在0.5mol·L-1H2SO4介质中,测定混合离子溶液中各自的浓度。测定
的工作波长为440nm,测定
的工作波长为550nm,当比色皿厚度b=1.0cm时,对下述三种溶液测得的吸光度数值如下:
试样 | 浓度 C/mol·L-1 | 吸光度A (λ=440nm) | 吸光度A (λ=550nm) |
纯Cr_2O_7^{2-} | 8.73×10-4 | 0.308 | 0.009 |
纯MnO_4^- | 3.73×10-4 | 0.035 | 0.886 |
Cr_2O_7^{2-}+MnO_4^- | 未知 | 0.385 | 0.653 |
试计算未知液中各自的浓度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“在0.5mol·L-1H2SO4介质中,测定混合离子溶液中各…”相关的问题
更多“在0.5mol·L-1H2SO4介质中,测定混合离子溶液中各…”相关的问题
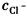 的实验结果如下:
的实验结果如下: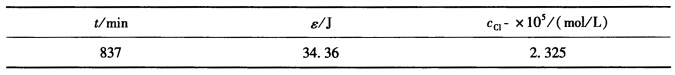 当用同样的样品在暗室中进行实验时,发现每分钟有3.5×10-10mol/L的Cl-生成。试计算该反应的量子效率
当用同样的样品在暗室中进行实验时,发现每分钟有3.5×10-10mol/L的Cl-生成。试计算该反应的量子效率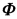 。
。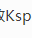 =1.8×10-5)溶液中加入NH4Cl固体,使c(NH4Cl)=0.2mol·L-1(忽略体积变化),此溶液的pH约为( )。
=1.8×10-5)溶液中加入NH4Cl固体,使c(NH4Cl)=0.2mol·L-1(忽略体积变化),此溶液的pH约为( )。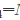 Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()
Na2SO4+S↓+SO2↑+H2O在室温下反应,以下4组溶液最先出现浑浊的是()
















