 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在锌-铜原电池中,锌电极 ()
A.负极,发生氧化反应
B. 负极,发生还原反应
C. 正极,发生氧化反应
D. 正极,发生还原反应
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.负极,发生氧化反应
B. 负极,发生还原反应
C. 正极,发生氧化反应
D. 正极,发生还原反应
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在锌-铜原电池中,锌电极 ()A. 负极,发生氧化反应B. …”相关的问题
更多“在锌-铜原电池中,锌电极 ()A. 负极,发生氧化反应B. …”相关的问题
下列叙述中正确的是( )。
(A) 因为电对Ni2++2e====Ni的 为-0.23V,所以2Ni2++4e====2Ni的
为-0.23V,所以2Ni2++4e====2Ni的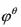 为-0.46V
为-0.46V
(B) 含氧酸根的氧化能力通常随溶液的pH减小而增强
(C) 因为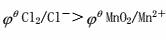 ,所以绝对不能用MnO2与盐酸作用制取Cl2
,所以绝对不能用MnO2与盐酸作用制取Cl2
(D) 已知 (Zn2+/Zn)和
(Zn2+/Zn)和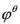 (Cu2+/Cu)分别为:-0.762V和0.342V,铜锌原电池的电动势大于0时,Cu2+的浓度总大于Zn2+的浓度
(Cu2+/Cu)分别为:-0.762V和0.342V,铜锌原电池的电动势大于0时,Cu2+的浓度总大于Zn2+的浓度
在0.50mol·L-1H2SO4溶液中电解1.00×10-3mol·L-1ZnSO4溶液,锌是否可在镀锌的铂电极上析出?如果介质c(H+)=1.00×10-5mol·L-1时,锌是否能析出?已知,在锌电极上η(H2)=-0.70V,
298K时,某电池的E和EΘ分别为1.00V和1.10V,对应的电池反应为Zn(s)+Cu2+==Zn2++Cu(s)。下面哪种说法能正确解释E和EΘ的差别()
A.锌电极的电解质溶液为Zn(NO)3,铜电极的电解质溶液为CuSO4
B.Zn2+浓度大于Cu2+浓度
C.两半电池具有不同的体积
D.盐桥中的电解质为KCl
在浓度一定的锌盐溶液中,如插入面积不同的锌片,则大锌片构成的电极,其电极电势会比小锌片的高。( )
已知