 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
0.080mol·dm-3的AgNO3和0.080mol·dm-3的HOCN等体积混合后,溶液中残留的c(Ag+)为多少?((AgOCN)=2.3×10-7,(HO
0.080mol·dm-3的AgNO3和0.080mol·dm-3的HOCN等体积混合后,溶液中残留的c(Ag+)为多少?(

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
0.080mol·dm-3的AgNO3和0.080mol·dm-3的HOCN等体积混合后,溶液中残留的c(Ag+)为多少?(

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“0.080mol·dm-3的AgNO3和0.080mol·d…”相关的问题
更多“0.080mol·dm-3的AgNO3和0.080mol·d…”相关的问题
11.为制备AgI负溶胶,应向25cm30.016mol·dm-3的KI溶液中加多少cm30.005mol·dm-3的AgNO3溶液?
在500cm31.5mol·dm-3的AgNO3溶液中,若不致因加入0.20mol的固体KBr而析出AgBr沉淀,则
3.298K,向Ag,AgNO3组成的半电池中加入HCl至其中Cl-浓度为0.5mol·dm-3时求Ag+/Ag电对的电极电势?
下列物质的酸性水溶液(浓度均为1.0mol·dm-3),分别通入100kPa的氧气,能发生反应的是
已知: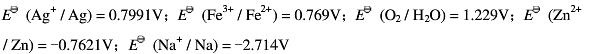 。
。
(A) AgNO3(B) ZnCl2(C) FeSO4(D) NaNO3
 溶液中逐滴加入AgNO3溶液,要求只生成Ag2C2O4沉淀,而又不会生成Ag2O沉淀,则溶液的pH应是( )。
溶液中逐滴加入AgNO3溶液,要求只生成Ag2C2O4沉淀,而又不会生成Ag2O沉淀,则溶液的pH应是( )。A.<7.9
B.<10.4
C.>10.6
D.<9.7
5.将Ag电极插入AgNO3溶液,Cu电极插入0.1mol·dm-3的Cu(NO3)2溶液,两个半电池相连,在Ag半电池中加入过量KBr以产生AgBr沉淀,并使AgBr饱和溶液中c(Br-)=0.1mol·dm-3,测得电动势为0.21V,Ag电极为负极,试求AgBr溶度积常数?
分别计算cHCl=0.020mol·dm-3和cHCl=3.0×10-7mol·dm-3的HCl溶液的pH值。
在NH3和
在298K时,反应 的各物质起始浓度分别为
的各物质起始浓度分别为
c(
c(
而
25℃时,若将0.010dm3、1.0mol·dm-3的CaCl2溶液和0.010dm3、0.20mol·dm-3的氨水混合后,溶液中c(OH-)=______mol·dm-3,反应商Q=[c(Ca2+)/c]·[c(OH-)/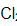 ]2=______,体系中______(填“有”或“无”)沉淀生成。(已知
]2=______,体系中______(填“有”或“无”)沉淀生成。(已知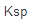 (NH3)=1.77×10-5,
(NH3)=1.77×10-5,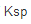 [Ca(OH)2]=5.5×10-6)
[Ca(OH)2]=5.5×10-6)