 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
反应CaCO3(s)→CaO(s)+CO2(g)的=179.2kJ·mol-1,故较高温度时,正反应可自发进行。
反应CaCO3(s)→CaO(s)+CO2(g)的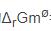 =179.2kJ·mol-1,故较高温度时,正反应可自发进行。
=179.2kJ·mol-1,故较高温度时,正反应可自发进行。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
反应CaCO3(s)→CaO(s)+CO2(g)的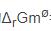 =179.2kJ·mol-1,故较高温度时,正反应可自发进行。
=179.2kJ·mol-1,故较高温度时,正反应可自发进行。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“反应CaCO3(s)→CaO(s)+CO2(g)的=179.…”相关的问题
更多“反应CaCO3(s)→CaO(s)+CO2(g)的=179.…”相关的问题
CaCO3(s)==CaO(s)+CO2(g)的标准平衡常数为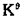 ,则CaCO3的分解压p=
,则CaCO3的分解压p=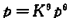 。()
。()
A.错误
B.正确
一定温度下,反应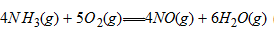 处于平衡态,若将CaO加倍,下列叙述正确的是
处于平衡态,若将CaO加倍,下列叙述正确的是
(A) 反应商加倍 (B) 反应商减半 (C) CaCO3量增加 (D) P(CO2)不变
A.△rHmθ<0,△rSmθ>0
B.△rHmθ>0,△rSmθ<0
C.△rHmθ<0,△rSmθ<0
D.△rHmθ>0,△rSmθ>0
已知反应:①C(s)+O2(g)→CO2(g),




已知反应Fe3O4(s)+CO(g)====3FeO(s)+CO2(g)的
已知反应FeO(s)+C(s)====CO(g)+Fe(s)的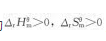 ,假定
,假定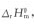 和
和 不随温度而变,则下列关于此反应叙述中正确的是( )。
不随温度而变,则下列关于此反应叙述中正确的是( )。
(A) 低温下自发过程,高温下非自发过程 (B) 低温下非自发过程,高温下自发过程
(C) 任何温度下均为非自发过程 (D) 任何温度下均为自发过程
A、0.514
B、0.315
C、0.413
D、0.614
反应C(s)+H2O(g)=CO(g)+H2(g),为提高C(s)的转化率,可采取()措施。
A.增加C(s)的用量
B.增加H2O(g)的浓度
C.按1:1增加,C(s)和H2O(g)的用量
D.以上三种方法都可以
下列反应中,
(A) CO(g)+Cl2(g)→COCl2(g) (B) 2NO2(g)→N2O4(g)
(C) NH4HS(s)→NH3(g)+H2S(g) (D) 2HBr(g)→H2(g)+Br2(l)
制造水煤气CO(g)+H2(g)时,需轮换向炽热的碳中分别鼓入水蒸气和空气,交替发生下列二反应:
(1)c(s)+H2O(g)=CO(g)+H2(g),
(2)C(s)+O2(g)=CO2(g),
试根据化学平衡原理说明鼓入空气的目的。