 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在含有Cu2+、Zn2+浓度相同的溶液中,试解释下列现象:
在含有Cu2+、Zn2+浓度相同的溶液中,试解释下列现象:
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在含有Cu2+、Zn2+浓度相同的溶液中,试解释下列现象:
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“在含有Cu2+、Zn2+浓度相同的溶液中,试解释下列现象:”相关的问题
更多“在含有Cu2+、Zn2+浓度相同的溶液中,试解释下列现象:”相关的问题
在1cm3池内含有某种待分析质的溶液并已知在470nm处产生吸收,消光系数ε为103。在池中用水将吸光度调至零。当分析质放入池中并置于光谱仪中,吸光度A为0.850时,问待分析质溶液的浓度为多少?
用极谱法分析测定某0.200 g试样中Zn2+的质量分数。在0.1mol?L-1NH3一NH4Cl溶液中加入0.05%的动物胶及0.5%Na2SO3除氧,测得试样的极限扩散电流为41.7uA。与试样作同样处理的标准zn2+的质量及波高如下。计算试样中zn2+的质量分数。

研究下列化学振荡:H2O2与KIO3在稀H2SO4溶液中的催化反应,在一定条件下,释放出O2的速率以及12的浓度会随时间呈周期性的变化。其主要反应(离子方程式)为(1)

当系统中有过量的H2O2参与并含有淀粉指示剂时,这种振荡能显示出蓝色和无色的周期性变化。请配平酸性溶液中进行的化学振荡(离子)反应(1)和(2),并说明其中H2O2所起的作用。
在0.10 mol·L-1HNO,介质中电解Cu2+,在阴极得到0.600 0 g的铜(M(Cu):63.55 g·mol-1),电解液的体积为150.00 mL,计算电解质中酸的最后浓度为多少?
A.假定溶液中各种离子不存在相互作用力
B.在溶液中不同电荷的离子间存在吸引力
C.电荷相同的离子间存在着相互排斥的作用力
D.离子与溶剂间可能存在引力或排斥作用力
E.由于上述力的存在,增强了离子在反应中的作用
设有一液体含有0.10mol.L-1Ba2+及0.10mol.L-1Sr2+,如欲借K2CrO4试剂使两种离子分离(设残留在溶液中的正离子浓度为1.0×10-5mol.L-1),CrO42-浓度应控制在何种范围(
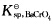 =1.6×10-10;
=1.6×10-10;
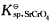 =3.5×10-5)?
=3.5×10-5)?
A.KspΘ(MnS)<KspΘ(CuS)<KspΘ(CdS)<KspΘ(PbS)
B.KspΘ(MnS)<KspΘ(CuS)、KspΘ(CdS)、KspΘ(PbS)
C.KspΘ(MnS)>KspΘ(CuS)、KspΘ(CdS)、KspΘ(PbS)
D.KspΘ(MnS)>KspΘ(CuS)>KspΘ(CdS)>KspΘ(PbS)
A.2mol/L
B.0.17%
C.3.04×10⁻⁴mol/L
D.0.71×10⁻⁴mol/L