 更多“所有顺磁分子中的未成对电子都是自由电子。()”相关的问题
更多“所有顺磁分子中的未成对电子都是自由电子。()”相关的问题
第1题
下列说法正确的是()。
A.中心原子中的几个原子轨道杂化时,必形成数目相同的杂化轨道
B.sp²杂化轨道是由某个原子的1s轨道和2p轨道混合形成的
C.原子在基态时没有未成对电子就一定不能形成共价键
D.在CCl₄、CHCl₃和CH₂Cl₂分子中,碳原子都采用sp³杂化,因此这些分子都是呈正四面体形
第4题
由磁矩测出在[Fe(CN) 6 ] 3- 中,中心离子的 d 轨道上有 1 个未成对电子,则这个未成对电子应排
由磁矩测出在[Fe(CN) 6 ] 3- 中,中心离子的 d 轨道上有 1 个未成对电子,则这个未成对电子应排布在分裂后的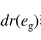 轨道上。()
轨道上。()
第5题
由磁矩测出在 中,中心离子的 d 轨道上有 5 个未成对电子,所以可知 的中心离子 d 轨道分裂能小
由磁矩测出在 中,中心离子的 d 轨道上有 5 个未成对电子,所以可知
中,中心离子的 d 轨道上有 5 个未成对电子,所以可知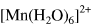 的中心离子 d 轨道分裂能小于电子成对能。()
的中心离子 d 轨道分裂能小于电子成对能。()
第10题
元素X的原子最外层电子排布式为nsnpn+1,则可判断该原子的未成对电子数是()。A.1B.2C.3D.4
元素X的原子最外层电子排布式为nsnpn+1,则可判断该原子的未成对电子数是()。
A.1
B.2
C.3
D.4
第11题
证明总自旋不为零的离子中,未填满壳层贡献的顺磁化率χp和内壳层贡献的抗磁化率χd之比为 其中Z是满壳层
证明总自旋不为零的离子中,未填满壳层贡献的顺磁化率χp和内壳层贡献的抗磁化率χd之比为

其中Z是满壳层中的总电子数,J是原子自旋量子数。


 如果结果不匹配,请
如果结果不匹配,请 

















