 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应:S(s)+H2(g)H2S(g) =1.0×10-3 S(s)+O2(g)SO2(g) =5.0×106 计算下列反应
已知反应:S(s)+H2(g)
 H2S(g)
H2S(g)
 =1.0×10-3 S(s)+O2(g)
=1.0×10-3 S(s)+O2(g)
 SO2(g)
SO2(g)
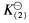 =5.0×106 计算下列反应的
=5.0×106 计算下列反应的
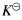 值。
值。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知反应:S(s)+H2(g)
 H2S(g)
H2S(g)
 =1.0×10-3 S(s)+O2(g)
=1.0×10-3 S(s)+O2(g)
 SO2(g)
SO2(g)
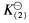 =5.0×106 计算下列反应的
=5.0×106 计算下列反应的
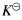 值。
值。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知反应:S(s)+H2(g)H2S(g) =1.0×10-…”相关的问题
更多“已知反应:S(s)+H2(g)H2S(g) =1.0×10-…”相关的问题
知下列反应的标准平衡常数 H2(g)+S(s)===H2S(g) K1θ S(s)+O2(g)===SO2(g) K2θ 则反应
 的标准平衡常数是 ()
的标准平衡常数是 ()
A.K1θ一K2θ
B.K1θ.K2θ
C.K2θ/K1θ
D.K1θ/K2θ
下列反应中,
(A) CO(g)+Cl2(g)→COCl2(g) (B) 2NO2(g)→N2O4(g)
(C) NH4HS(s)→NH3(g)+H2S(g) (D) 2HBr(g)→H2(g)+Br2(l)
已知:C2H4(g),C(s),H2(g)的燃烧热分别为-1411.2kJ·mol-1,-393.5kJ·mol-1和-285.8kJ·mol-1,试求
(1) C2H4(g),H2(g),C(s)的燃烧反应的热化学反应方程式;
(2) C2H4(g)标准摩尔生成热。
 H2(g)+FeO(s)====H2O(g)+Fe(g)
H2(g)+FeO(s)====H2O(g)+Fe(g) 则反应CO(g)+FeO(s)====Fe(g)+CO2(g)
则反应CO(g)+FeO(s)====Fe(g)+CO2(g) ( )。
( )。A.m+n
B.m-n
C.m×n
D.n/m
A.K1+K2+K3
B.K1-K2-K3
C.K1K2K3
D.K1K3/K2
已知下列反应在750℃时的KΘ:
(1)(1/2)snO2(s)+H2(g)===(1/2)Sn(s)+H2O(g),
(2)H2(g)+CO2(g)===CO(g)+H2O(g),
求反应(3)(1/2)SnO2(s)+CO(g)===Sn(s)+CO2(g)在750℃的
电池Mo(S)|MoS2(S)|H2S(100kPa)|KCl(0.01mol/kg)|HCl(0.01mol/kg)|H2(100kPa)|Pt,测得其在不同温度下的电池电动势数据为 T/K 288 298 308 E/V 0.4148 0.4119 0.4087 (1)写出电极反应和电池反应; (2)由题给数据推导出电池反应的平衡常数与温度的关系式,并计算△rHm; (3)用电化学方法计算298K时电池反应的△rSm,将其与热力学方法计算所得结果相比较可得出什么结论?298K时,物质的规定熵数据为 物质 H(g)H2S(g) Mo(s) MoS2(s) Sm/[J/(K.mol)] 130.6 205.6 28.58 62.59
 ②N2(g)+3H2(g)====2NH3(g)
②N2(g)+3H2(g)====2NH3(g) ③NH3(g)+HBr(g)====NH4Br(s)
③NH3(g)+HBr(g)====NH4Br(s) 则NH4Br(s)的标准摩尔生成热
则NH4Br(s)的标准摩尔生成热 =( )kJ/mol。
=( )kJ/mol。A.-270.83
B.270.83
C.-176.20
D.176.20
将水蒸气通过灼热的煤制备水煤气时的主要反应为:C(s)+ H2O(g)=CO(g)+H2(g),副反应为:C(s)+2H2O(g)=CO2(g)+2H2(g)。将此混合气体冷却至室温即为水煤气,其中含CO、H2和少量CO2,水蒸气可以忽略不计。试计算25℃、100kPa时燃烧1dm3水煤气放出的热量,假设产物均为气体。(1)若只计主反应;(2)若有95%的C(s)生成CO,5%的c(s)生成C02。已知:△fHmθ(H2O,g)=-241.82kJ.mol-1,△fHmθ(CO2,g)=-393.51kJ.mol-1,△fHmθ(CO,g)=-110.53kJ.mol-1。